Termenii „anod” și „catod” sunt fundamentali în domeniul electrochimiei și al circuitelor electronice. Aceste două tipuri de electrozi joacă roluri esențiale în diverse sisteme, de la baterii simple până la tehnologii de vârf.
Vom analiza diferențele dintre acești electrozi, etichetele lor, pozitiv și negativ, și cum putem identifica cu ușurință polaritatea fiecăruia.
Ce reprezintă un electrod?
Este vital să înțelegem conceptul general al unui electrod înainte de a ne adânci în complexitatea noțiunilor de catod sau anod. În esență, un electrod este un material care facilitează conducerea electricității, permițând curentului să intre sau să iasă dintr-un mediu nemetalic, cum ar fi o celulă electrolitică.
Simplificând, un electrod acționează ca un conductor, creând un contact electric cu o componentă nemetalică a unui circuit.
Ce este un anod?
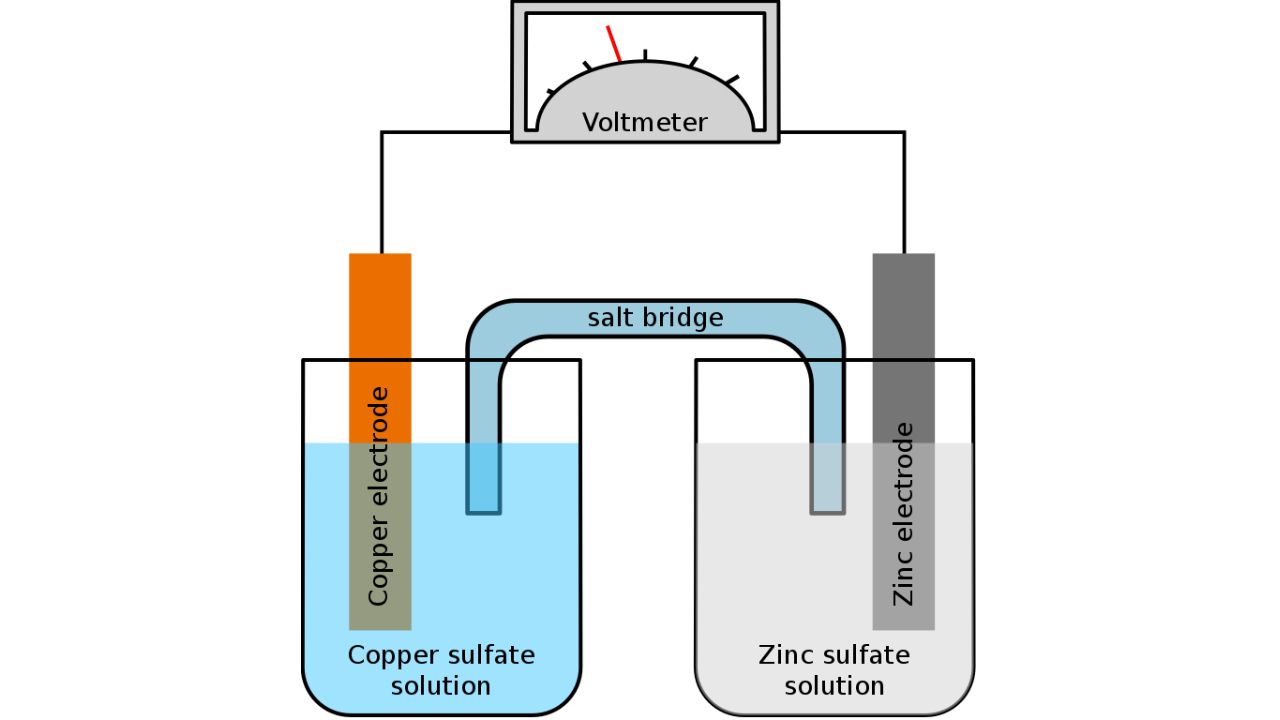
Polaritatea unui electrod, fie el anod sau catod, variază în funcție de tipul circuitului. Anodul este electrodul unde are loc procesul de oxidare, care implică pierderea de electroni. Într-o celulă galvanică (unde energia chimică este transformată în energie electrică, cum se întâmplă la descărcarea unei baterii), anodul este electrodul negativ, deoarece, în timpul oxidării, electronii sunt eliberați și se deplasează prin circuitul extern.
Însă, în electroliză, unde curentul electric este cel care determină fluxul de electroni în direcția opusă, anodul devine electrodul pozitiv.
Ce este un catod?
 Credit imagine: Raspberry Pi
Credit imagine: Raspberry Pi
Catodul este locul unde se petrece reducerea, adică acceptarea de electroni. Într-o celulă galvanică, acesta este un electrod pozitiv, unde ionii sunt supuși reducerii prin captarea electronilor de la electrod.
În electroliză, catodul este polul negativ, atrăgând ionii pozitivi din soluție.
Anod vs. Catod: Clarificarea polarității
Inițial, se credea eronat că electricitatea curge de la pozitiv la negativ, invers față de ceea ce știm acum că este real. Această neînțelegere a dus la asocierea anodului cu polaritatea negativă, iar catodul cu polaritatea pozitivă.
Cu toate acestea, odată cu înțelegerea corectă a rolurilor oxidării și reducerii, este simplu de identificat anodul și catodul. Acest lucru depinde de tipul specific de circuit.
Care este rolul electrolitului într-o baterie?
 Credit imagine: Tinux/gringer/Wikimedia Commons
Credit imagine: Tinux/gringer/Wikimedia Commons
În baterii, electrolitul este mediul care permite fluxul de ioni între anod și catod, menținând neutralitatea electrică a ansamblului. Acest transfer ionic este esențial pentru reacțiile chimice care au loc în timpul proceselor de încărcare și descărcare. Pentru mai multe detalii, puteți consulta funcționarea bateriilor litiu-ion folosite la autovehicule electrice.
Care dintre electrozi este pozitiv?
Pentru a înțelege polaritatea electrozilor într-o celulă sau circuit, trebuie să analizăm reacțiile care au loc în cele două puncte. Într-o celulă galvanică, anodul este supus oxidării și funcționează ca electrod negativ, în timp ce în electroliză, acesta devine electrodul pozitiv. Catodul, pe de altă parte, facilitează reducerea și acționează ca electrod pozitiv într-o celulă galvanică, dar ca pol negativ în electroliză.